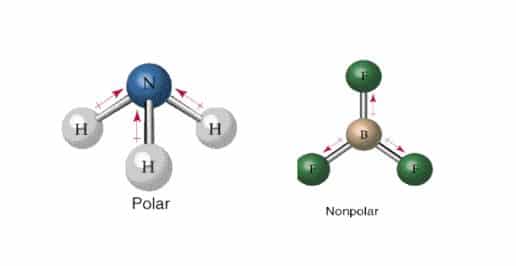
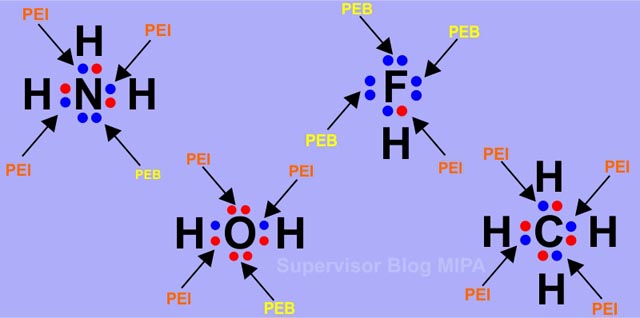
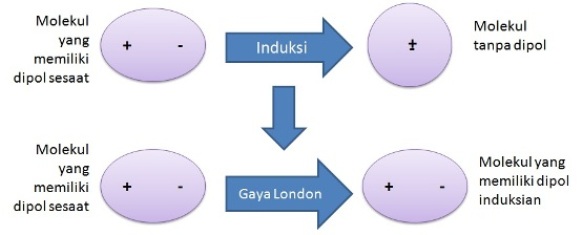
Perbedaan ekstrim membentuk ikatan ion sedangkan perbedaan yang lebih rendah membentuk ikatan. Sebuah dipol bentuk dengan bagian dari molekul membawa muatan positif sedikit dan bagian lain yang membawa muatan negatif sedikit.

Pengertian Senyawa Ion Dan Kovalen Polar لم يسبق له مثيل
10 contoh senyawa polar dan nonpolar. Dua kelas utama molekul adalah molekul polar dan molekul nonpolar. Atau ikatan kovalen nonpolar adalah ikatan kovalen yang pasangan elektron ikatannya pei tertarik sama. Hal tersebut tidak mengakibatkan terjadinya pemisahan kutub oleh karena itu cl 2 adalah senyawa nonpolar. Ok mari kita kerjakan. Ikatan antara 8 o dengan 8 o. Senyawa polar terbentuk baik sebagai hasil dari atom elektronegatif atau karena pengaturan asimetris dari ikatan nonpolar dan pasangan elektron mandiri pada senyawa yang sama.
Contoh lain yang saya punya adalah senyawa lain yang memiliki bentuk molekul simetris dan bersifat nonpolar adalah ch 4 bh 3 bcl 3 pcl 5 dan co 2. Untuk dapat menentukan senyawa tersebut termasuk senyawa polar atau nonpolar kita harus mengetahui struktur lewis nya terlebih dahulu. Perhatikan struktur salah satu ikatan kovalen non polar dari ch 4 berikut. Ikatan kovalen tersebut dinamakan ikatan kovalen non polar. Hal ini terjadi ketika ada perbedaan antara elektronegativitas dari setiap atom. Molekul senyawa berikut yang bukan merupakan senyawa kovalen polar adalah.
Contoh senyawa lain yang memiliki bentuk molekul simetris dan bersifat nonpolar adalah ch 4 bh 3 bcl 3 pcl 5 dan co 2. Contoh molekul polar dan nonpolar adalah topik yang kami ulas. Ikatan kovalen nonpolar adalah ikatan kovalen yang pasangan elektron ikatannya pei tertarik sama kuat ke arah atom atom yang berikatan. Selain itu aseton adalah pelarut yang kuat karena merupakan bahan yang mudah larut. Dengan demikian pada senyawa yang berikatan kovalen tidak terjadi pengutuban muatan. Molekul polar terjadi ketika dua atom tidak berbagi elektron sama di ikatan kovalen.
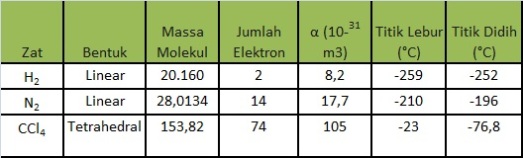
Beberapa molekul jelas polar atau nonpolar tetapi banyak juga yang memiliki polaritas yang apa itu contoh molekul polar dan nonpolar dibahas dengan jelas disini semoga bermanfaat. Perhatikan struktur salah satu ikatan kovalen non polar dari ch 4 berikut. Karena kemampuannya untuk melarutkan kedua senyawa polar dan nonpolar aseton dianggap oleh banyak orang sebagai pelarut yang sangat baik sebagian besar pelarut lain hanya dapat melarutkan senyawa polar atau non polar. Molekul cl 2 terdiri dari 2 atom yang sama yaitu cl sehingga selisih keelektronegatifannya adalah 0. Contoh contoh berikut akan menjelaskan dua fenomena tersebut dengan cara yang lebih terperinci. Jika dua atom nonlogam sejenis diatomik membentuk suatu senyawa kovalen misalkan h 2 n 2 br 2 dan i 2 maka ikatan kovalen yang terbentuk memiliki keelektronegatifan yang sama atau tidak memiliki perbedaan keelektronegatifan.
Senyawa kovalen dikatakan non polar jika senyawa tersebut tidak memiliki perbedaan keelektronegatifan. Lihat juga materi kimia lainnya.